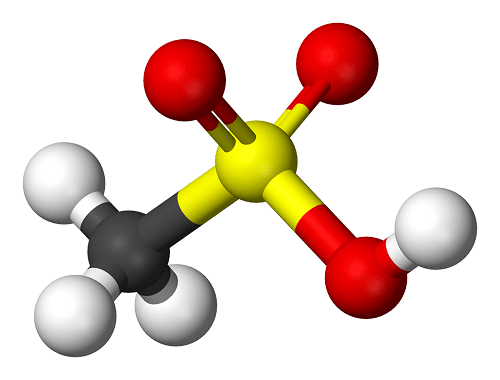
El ácido sulfúrico, es un líquido oleoso e incoloro, muy corrosivo, deshidratante, que carboniza la materia orgánica.
Es un compuesto del azufre, y quizás una de las mezclas químicas más conocida, debido a su alto poder abrasivo.
Representa la mixtura química más producida a nivel mundial, debido a que posee una infinidad de usos.
Sus niveles de producción se utilizan para medir la capacidad industrial que presenta un determinado país.
Se obtuvo industrialmente por primera vez en Inglaterra, en la segunda mitad del siglo XVIII, cuando se empleó en un método llamado “cámaras de plomo”, un procedimiento que en la actualidad está en desuso.
El descubrimiento del ácido sulfúrico está relacionado con el alquimista Jabir ibn Hayyan, también conocido como Geber, cuando quería obtener de una mezcla del sulfato de cobre y sulfato de hierro mediante el calentamiento y la recolección de vapores.
De este experimento se originó un líquido oleoso capaz de disolver una gran cantidad de sustancias que llamó vitriolo.
Posteriormente, en Europa se fueran traduciendo del idioma árabe las fórmulas usadas por Geber.
Es el siglo XVII, que el científico alemán Johann Glauber, obtiene el ácido sulfúrico a partir del quemado de azufre con nitrato de potasio.
Este método fue el usado para crear el compuesto a gran escala, con mejoras para obtener mayor concentración y pureza.
Propiedades del ácido sulfúrico. Precauciones.

Entre las propiedades puras del ácido sulfúrico se encuentran las siguientes:
- Es soluble al agua y viscoso.
- Fuertemente corrosivo con prácticamente todos los metales y tejidos.
- Carboniza la madera y la mayor parte de la materia orgánica.
- Al entrar contacto con el agua genera gran cantidad de calor, actuando como agente deshidratante.
- Posee un alto punto de ebullición que sirve para producir ácidos volátiles.
- Aunque no es inflamable puede generar oxígeno para la combustión de otros materiales.
- Produce explosión al entrar en contacto con el para-nitrotolueno y permanganato de potasio.
- Este componente es altamente peligroso al unirse con carburos bromatos, cloratos, pricatos y metales en polvo.
- Mezclándolo con ácido clorosulfúrico se obtiene ácido clorhídrico.
Las reacciones del ácido sulfúrico alcanzan la salud humana, por ello es conveniente tomar medidas de prevención:
- La inhalación de vapores de este ácido pueden causar grave daño pulmonar, debido al humo que emite es altamente tóxico.
- Al contacto con los ojos ocasiona la pérdida total de la vista, y con la piel quemaduras severas.
- Su ingestión, aunque sea una gota, son fatales para el hombre.
La manipulación del ácido sulfúrico, debe hacerse con mucho cuidado y protegido de acuerdo a las medidas de seguridad industrial, sobre todo porque al entrar en contacto con el agua produce una reacción violenta.
Aquellas personas que sufren de enfermedades respiratorias, gastrointestinales, oculares y cutáneas deben de evitar el contacto con el componente.
Estructura del ácido sulfúrico.
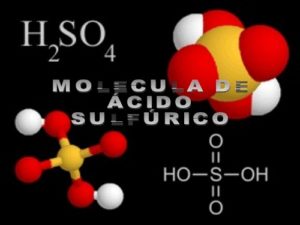
Comúnmente el ácido sulfúrico se obtiene del dióxido de azufre, por la oxidación del óxido de nitrógeno en líquido.
En este caso, la molécula presenta una estructura piramidal, donde el átomo de azufre se ubica en el centro y cuatro átomos de oxígeno en los vértices.
Los dos átomos de hidrógeno están unidos a los de oxígeno, y dependiendo de la combinación se pueden separar.
En la mezcla con agua se comporta como un ácido fuerte en su primera reacción de contacto, dando como resultado un anión de bisulfato, capaz de empezar la oxidación.
El efecto deshidratante del ácido sulfúrico sobre las moléculas de hidrocarbono se debe a su capacidad de captar las moléculas en forma de agua, dejando sueltos los átomos de carbono que formaran carbono puro.
Usos del ácido sulfúrico.

El mayor uso dado a este componente ha sido en el proceso industrial, siendo contadas las veces que se le encuentra en un producto para el consumidor final.
Aunque el sector que más demanda el ácido sulfúrico es el de fertilizantes, también es usado en la refinación del petróleo, tratamiento del acero, fabricación de explosivos y plásticos.
La industria química inorgánica lo emplea en la producción de pigmentos de óxido de titanio, ácido clorhídrico y ácido fluorhídrico. Es aplicado en los procesos de la madera, el papel, y textiles como en el tratamiento de pieles y fibras.
El uso más común en productos de consumo directo se encuentra en la elaboración de detergentes y limpiadores de baño.
Igualmente el componente es utilizado como precursor químico en la fabricación de cocaína.
También en la preparación de productos de belleza o farmacéuticos menores que requieren del proceso de sulfonación, como los jabones.
Las baterías constituyen uno de los productos de consumo que contienen ácido sulfúrico.
En las regiones desérticas de los Estados Unidos, se emplea en la agricultura para rehabilitar los suelos áridos, bajo supervisión.
La creciente demanda de ácido sulfúrico en el mundo se debe a la falta de producción de ácido fosfórico, dióxido de titanio, ácido fluorhídrico y sulfato de amonio.